Los extendidos de la superficie córneal en el diagnóstico de Queratitis por Acanthamoeba.
Imágenes clínicas e histo-patológicas.
Francisco Barraquer C. M.D.
La sospecha clínica de que una infección corneal es causada por Acantamoeba es la primera condición indispensable para llegar a su dignóstico temprano e iniciar su tratamiento, buscando su resolución y minimizar las secuelas.
Si el diagnóstico de una queratitis por Acantamoeba se hace en las primeras semanas de infección, cuando esta se halla en la fase superficial, su resolución con el tratamiento será rápida, minimizando las secuelas con respecto a lo que ocurre después de este tiempo, cuando el organismo está ya infiltrando y comprometiendo progresivamente el estroma corneal.
Los factores que influencian la severidad de la infección son determinados por la virulencia inherente al parasito, asociados a otros factores que influencian la rata de progresión clínica y anatómica, como la cepa del organismo, la magnitud de la exposición (carga) inicial, la presencia de presas para las Acanthamoebas y factores propios del huesped como la respuesta inmunitaria e integridad corneal.
Los diagnosticos diferenciales más importantes son las queratitis metaherpéticas y las queratomicosis.
En la serie de 26 casos diagnosticados y tratados por nosotros por queratitis infiltrativa por Acanthamoeba, 13 casos (50%) tuvieron una impresión diagnóstica clínica y tratamiento para una queratitis herpética la cual no respondía a la medicación, lo que representó una tardanza importante en el diagnóstico final de la infección por Acanthamoeba. Dos casos habían recibido tratamiento para queratomicosis.
Clínica
Superficie corneal irregular y grisácea, (Fig. 1, 2) con opácidades granulares en parche y formación de líneas epiteliales elevadas de aspecto granular (Fig. 3), que pueden arborizar dando imágenes de pseudodendritas. Opacidades superficiales satélites. (Figura 4) Inyección ciliar. Ulceración epitelial variante. (Figura 5).
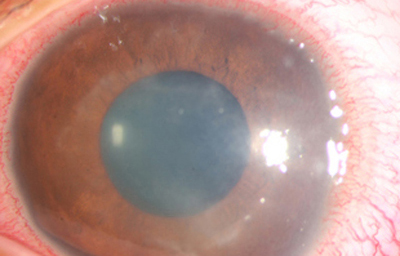
Fig. 1 Síntomas de 15 días evolución
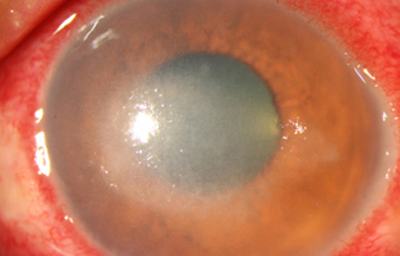
Fig. 2 Síntomas de 25 días evolución
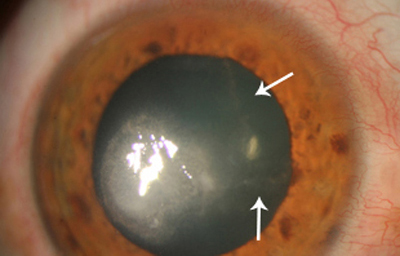
Fig. 3 Líneas epiteliales elevadas. Síntomas de 40 días evolución
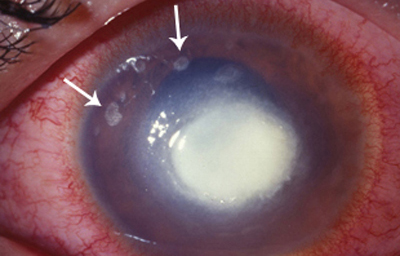
Fig. 4 Focos satélites. Síntomas de meses evolución.
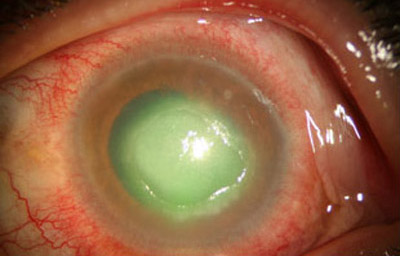
Fig. 5
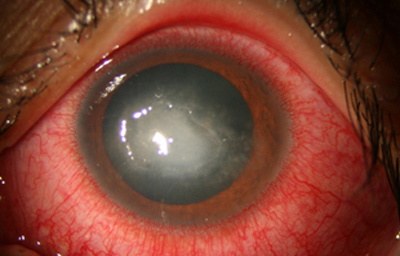
Fig. 6
Estas lesiones progresan con la aparición de infiltrados estromales anteriores difusos o focales, (Figura 6) edema circunscrito, y en ocasiones infiltrados en los nervios corneales (Figura 7), (perineuritis, usualmente entre las 1 a 4 semanas de evolución).
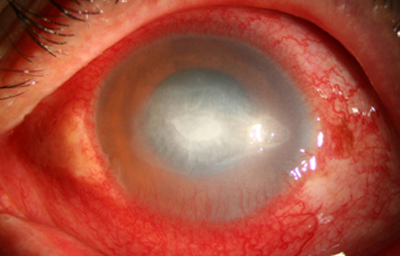
Fig. 7
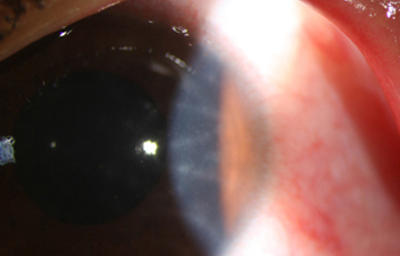
Fig. 8
En su evolución se observará aumento del edema, agrandamiento y coalescencia de los infiltrados formando un anillo, (Figura 9, 10 y 11) que progresa hacia la formación de un absceso (Figura 12, 13 y 14), queratolisis superficial, adelgazamiento y perforación corneal (Figura 15 y 16).
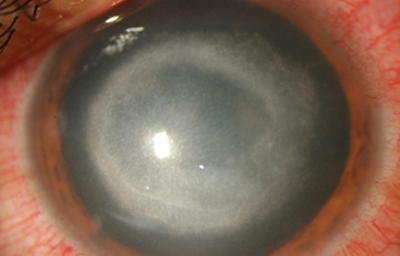
Fig. 9 Síntomas de 15 días evolución
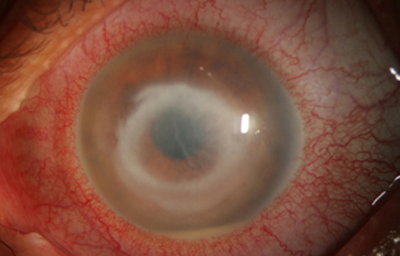
Fig. 10 Síntomas de 15 días evolución
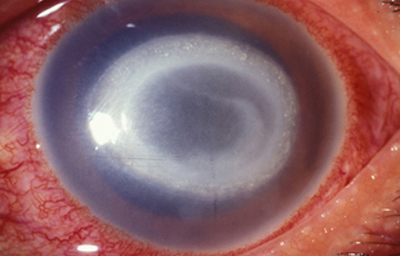
Fig. 11 Síntomas de 15 días evolución
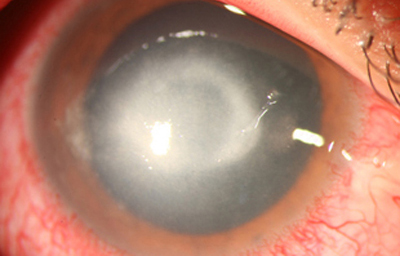
Fig. 12 Síntomas de 15 días evolución
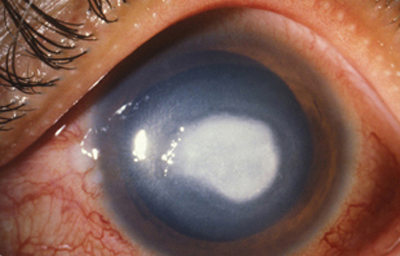
Fig. 13 Síntomas de 15 días evolución
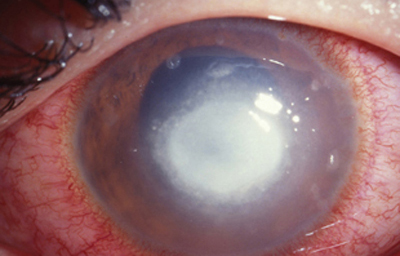
Fig. 14 Síntomas de 15 días evolución
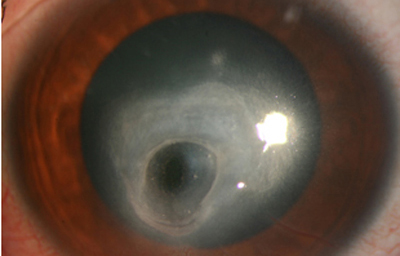
Fig. 15 Síntomas de 15 días evolución
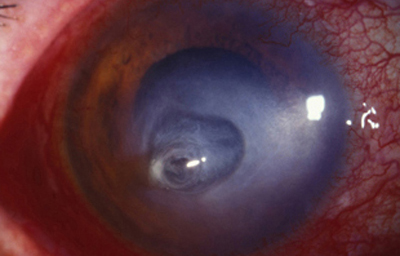
Fig. 16 Síntomas de 15 días evolución
Limbitis y escleritis anterior difusas.
La vascularización y el hipopion son poco frecuentes en los estadios tempranos de la queratitis. Con el tiempo, en los estados avanzados de invasión estromal, aparecen vasos estromales (Figura 17)
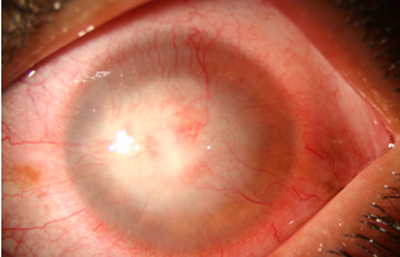
Fig. 17
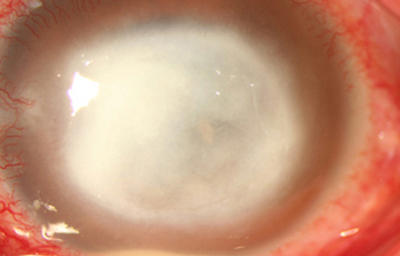
Fig. 18
Es llamativa la asociación de los infiltrados corneales a dolor desmedidamente intenso, frecuentemente más notable por la noche. Este síntoma no está siempre presente.
En los estados avanzados con abscesificación y queratolisis, se enmascara el cuadro corneal, ocultando las características clínicas típicas de la queratitis por Acanthamoeba. (Fig 18)
Tanto las Acanthamoebas vivas como sus productos de degradación son marcadamente antigénicos. En la respuesta celular a la infección por Acanthamoeba, los macrófagos las fagocitan (Fig 19) y los neutrófilos las destruyen vía secreción de mieloperoxidasas. (Figura 20) (Para no frenar la respuesta celular, preferimos no usar corticoides en el tratamiento de la infección activa). (El uso crónico de corticoides, en casos con superficie corneal alterada, es un factor primario en el desarrollo de una queratopatía cristalina infecciosa). La respuesta celular tiene como consecuencia, cuando la invasión por Acanthamoebas es estromal, que la abscesificación del estroma continuará aumentando a pesar del tratamiento, siendo su resolución lenta. (Figura 21, 22, 23, 24, 25, 26) (Figura, 27, 28, 29 y 30)
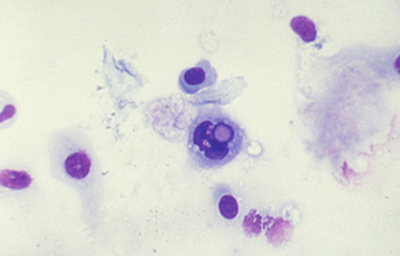
Fig. 19 Acanthamoeba fagocitada por macrófago. Giemsa, Original x160
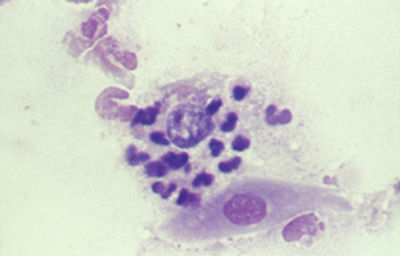
Fig. 20 Trofozoito rodeado por polimorfonucleares. Giemsa, Original x160
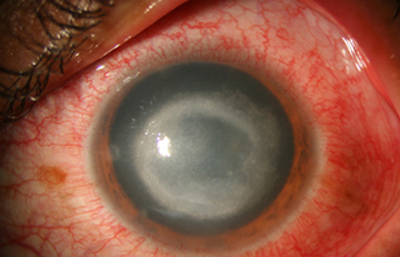
Fig. 21 Se inicia Clorhexidina (CHX) 0.02% cada hora.
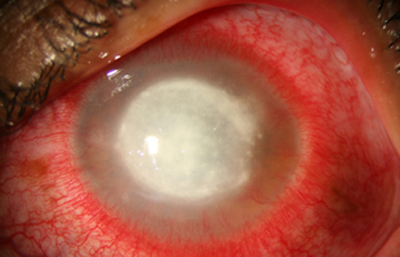
Fig. 22 CHX por 13 días. Síntomas de 36 días de evoluvión
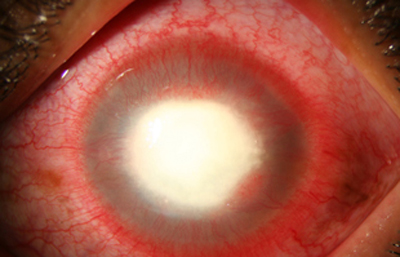
Fig. 23 CHX por 27 días
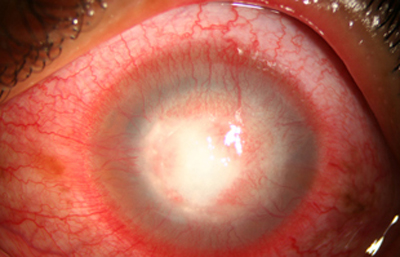
Fig. 24 CHX por 43 días
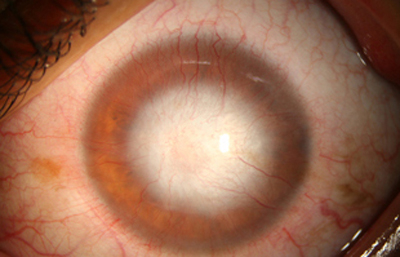
Fig. 25 CHX por 64 días. Se reduce CHX a 4 veces al día
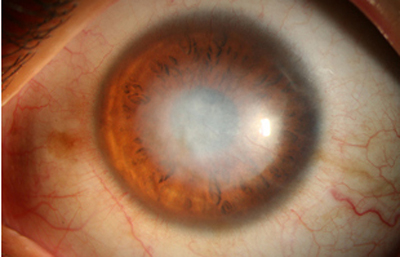
Fig. 26 CHX por 7 meses. Suspende la CHX
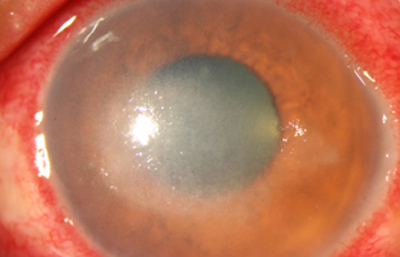
Fig. 27 Se inicia CHX. Síntomas de 30 días evolución
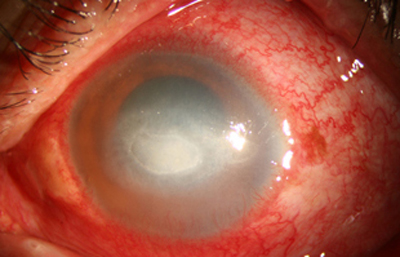
Fig. 28 HX por 52 días
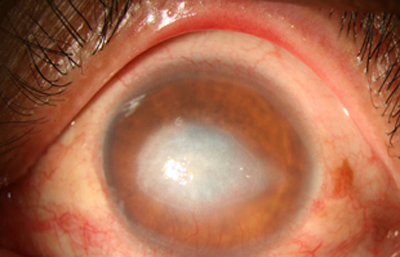
Fig. 29 CHX por 115 días
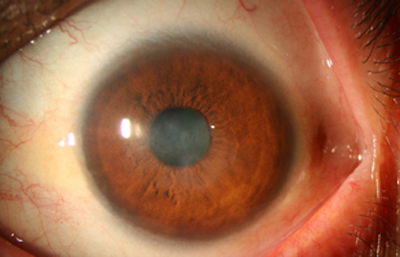
Fig. 30 Estado a los 8 meses
Diagnóstico
Ante la sospecha por los antecedentes e imágenes biomicroscópicas de una queratitis por Acantamoeba, debe hacerse su confirmación diagnóstica mediante extendidos de la superficie corneal para estudio microscópico, con las imágenes obtenidas “in vivo” con microscopía confocal (Figura 31 y 32) y mediante cultivos del parásito.
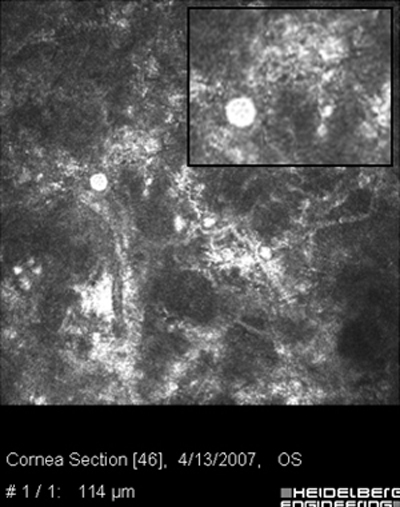
Fig. 31 Microscopía Confocal

Fig. 32 Comparar con quiste Acanthamoeba Fig 39
La positividad por la presencia de Acanthamoebas en uno o más estos estudios, asociada a las imágenes clínicas, confirma la etiología de la queratitis e indican la conducta terapéutica a seguir.
Ante la sospecha de una queratitis por Acanthamoeba se debe practicar un extendido, cureteando la superficie corneal con una espátula plana roma, en sentido paralelo a la superficie corneal. El material obtenido se coloca en una gota de agua destilada en el centro de un portaobjetos de vidrio limpio y se deja secar al aire. Una vez seco se fija con alcohol metílico de 95º-100º por 15 minutos. El extendido en estas condiciones está listo para se coloreado. Protejiendolo del polvo del medio ambiente puede guardarse por un tiempo prolongado. Si se van a emplear coloraciones de tipo Romanovsky, como la coloración de Giemsa, es recomendable usar como fijador el alcohol metílico. En su defecto puede usarse como fijador el alcohol etílico de 75º a 90º.
Al tiempo con la obtención de los extendidos corneales, pueden hacerse siembras en medios de cultivo de agar no nutriente-Escherichia Coli o en un medio de agar-peptona de caseina-extracto de levaduras-glucosa (PYG). La sensibilidad de los cultivos es de un 40 a 60%
Las coloraciones empleadas en extendidos corneales para visualizar los quistes y trofozoitos de Acanthamoebas usando métodos sencillos son múltiples, siendo las que nos parecen más recomendables las coloraciones de Giemsa y el Acido Periódico de Schiff (PAS), (Figura 33 y 34) ambas usuales en los laboratorios de patología.
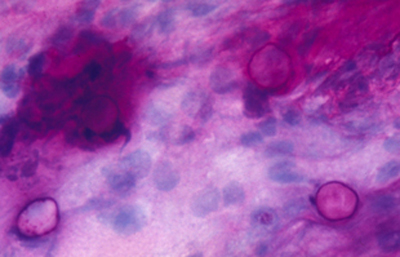
Fig. 33 PAS, Original x250
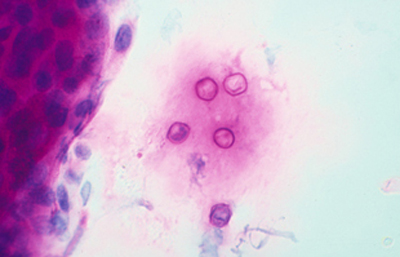
Fig. 34 PAS, Original x160
Otros métodos sencillos son los basados en la estimulación de fluorescencia, como el Blanco de Calcofluor y el Anaranjado de Acridina. Para ellas se requiere un microscopio de fluorescencia por reflexión y juegos de filtros en las longitudes de onda de excitación y de emisión del fluorocromo empleado.
El examen de las perparaciones sin colorear en campo claro y bajo Contraste de Fases también permite una buena visualización de las formas quísticas de Acanthamoeba. (Figura 35)
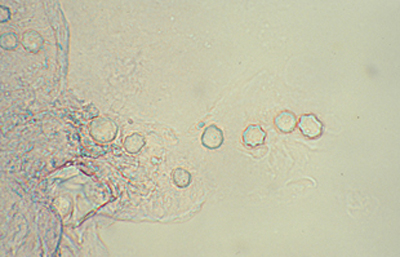
Fig. 34 Contraste de fase. Original x160
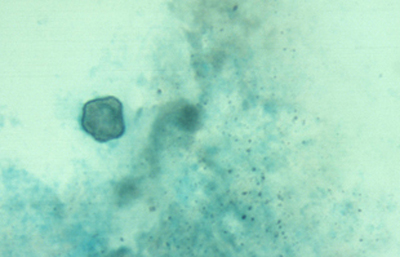
Fig. 34 Grocott. Original x250
En nuestra práctica empleamos usualmente el Contraste de Fases, el Blanco de Calcofluor, la coloración de Giemsa, y frecuentemente la de PAS. Las tres primeras son más sencillas y rápidas y pueden practicarse en un mismo extendido. Estas técnicas y coloraciones son las mismas que empleamos para el estudio de extendidos en queratitis micóticas.
Blanco de Calcofluor
El uso del fluorocromo Blanco de Calcofluor no es excluyente de otras coloraciones, pues al ser en base acuosa no es permanente y la preparación puede lavarse en agua corriente para luego ser coloreadas con Giemsa, PAS u otras coloraciones, con el fin de reconfirmar los hallazgos microscópicos y volverlas permanentes para guardarlas.
Blanco de Calcofluor: Sobre el porta-objetos con el extendido ya fijado colocar unas gotas de Blanco de Calcofluor al 0.1% y de Azul de Evans 0.1%. Esperar 3 minutos. Cubrirlo con un cubre-objetos. Retirar con papel de filtro el exceso de líquido que se exterioriza por los bordes del cubre-objetos. Examen en el microscópio de fluorescencia. Emplear filtro excitador de 365 nm. y de emisión de 450-490 nm. Algunos autores favorecen emplear un filtro de emisión con longitud de onda más larga, fuera de la banda azul, en 520-550 nm. si bien con estas longitudes de onda la visualización de la emisión fluorescente es menos intensa.
Las imágenes de Acanthamoebas muestran una cápsula circular u ondulada, refringente de color azulado o verde manzana, notablemente más intensa que los materiales y tejidos que la rodean. Suelen medir de 12 a 16 µm de diámetro. El contenido del quiste es azul tenue. (Figura 37 , 38, 39 y 40)

Fig. 37 Blanco de Calcofluor (CW). Original x160

Fig. 38 CW, Original x250
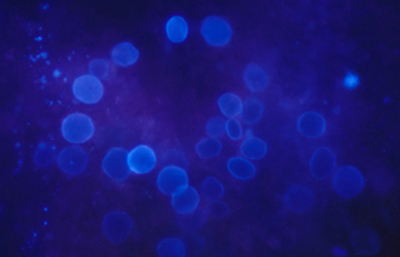
Fig. 39 CW, Original x160
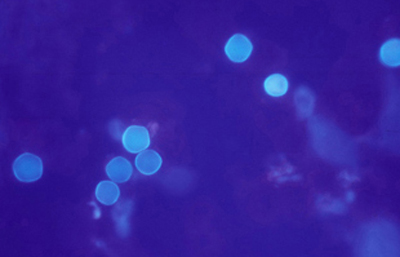
Fig. 40 CW, Original x160
Coloración de Giemsa
En un frasco de Copli colocar 10 ml de la solución del colorante de Giemsa con 90 ml de un buffer fosfato 1/15 M y pH 6.8. Colorear el extendido fijado por 20 minutos. Lavar en agua corriente y dejar secar al aire. Aclarar en xileno por 5 minutos y montar con un medio de resina.
Los quistes Acanthamoebas midien de 10 a 16 µm de diametro, con capsula de forma circular o poligonal, a veces con angulaciones y ondulaciones, (Figura 41) teñido densamente azul oscuro. Membrana plasmática con tinción más tenue, concéntica, o retraida o colapsada asimétricamente. Coloración variable del citoplasma. (Figura 42, 43, 44 y 45)
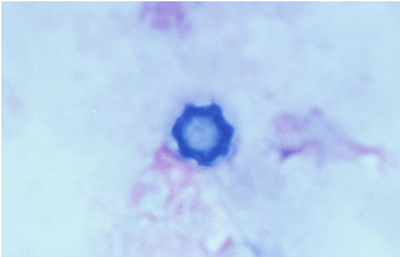
Fig. 41 Giemsa. Original x400
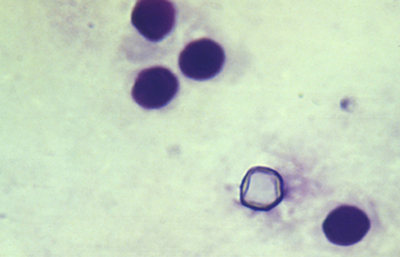
Fig. 42 Giemsa. Original x200
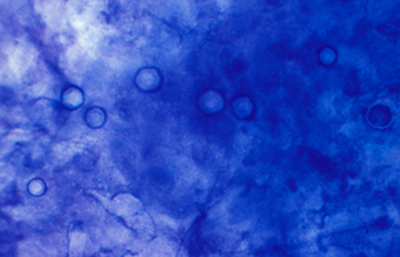
Fig. 43 Giemsa. Original x160
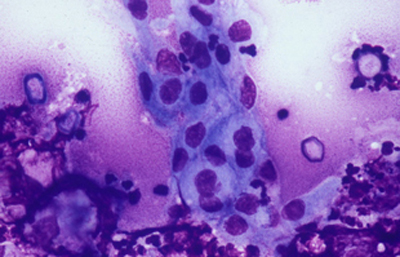
Fig. 44 Giemsa. Original x160
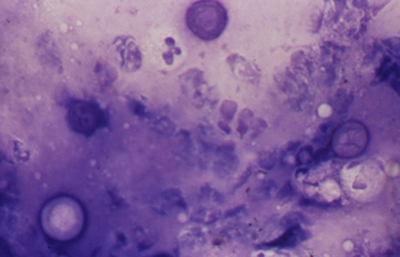
Fig. 45 Giemsa. Original x200
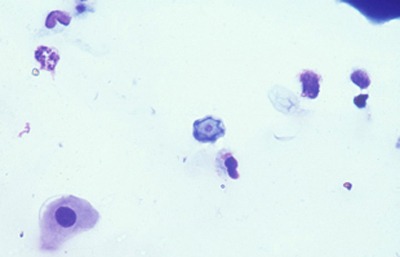
Fig. 46 Giemsa. Original x160
En ocasiones cariosoma central prominente (en ojo de buey) (Figura 46) y quistes claros, vacios, compuestos sólo por la doble pared del quiste y membrana plasmática.
Cuando los quistes se localizan en el epitelio o en detritus colágenos y fibrinoides, el ectoquiste puede ser refringente, transparente o tenuemente azulado y el tendoquiste densamente coloreado de azul por el Giemsa. (Figura 47)
Los trofozoitos son más difíciles de visualizar, siendo mayores que los quistes. En preparaciones fijadas, son de forma circular, con pequeño núcleo y citoplasma con numerosos organelos y vacuolas (Figura 48)
Ante un extendido negativo para quistes, en los casos en que hay una sólida sospecha clínica de queratitis por Acanthamoeba, recomendamos repetir el extendido. Los cultivos y las imágenes obtenidas con microscopía confocal pueden confirmar la queratitis por Acanthamoeba. También se puede acudir a la biopsia corneal.
Cuando el examen patológico se realiza en cortes de tejido corneal procesados en parafina, (biopsias y discos de córnea de queratoplastias) las coloraciones que empleamos usualmente son la coloración de Hematoxilina-Eosina (Figura 49), el Blanco de Calcofluor. (Figura 50), la de PAS (Figura 51 y 52). De nuevo, la consideración de que una infección corneal puede ser causada por Acantamoebas es la condición indispensable en el diagnóstico diferencial para llegar a su diagnóstico
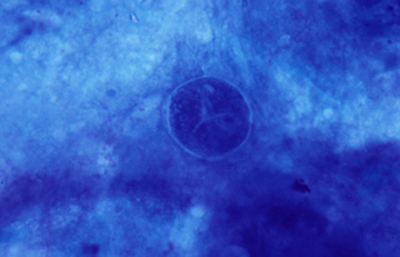
Fig. 47 Giemsa, Original x400
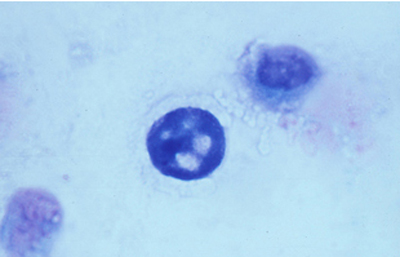
Fig. 48 Giemsa, Original x400
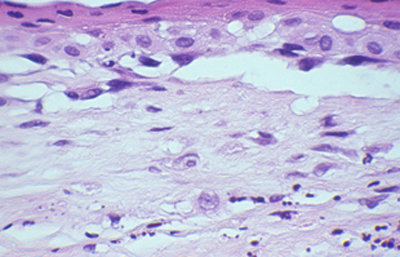
Fig. 49 H-E, Original x160
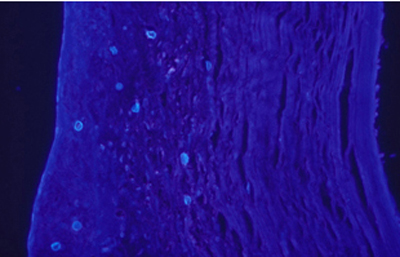
Fig. 50 CW, Original x160
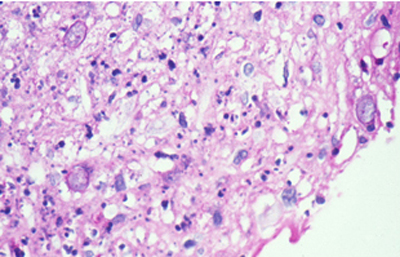
Fig. 51 PAS, Original x160
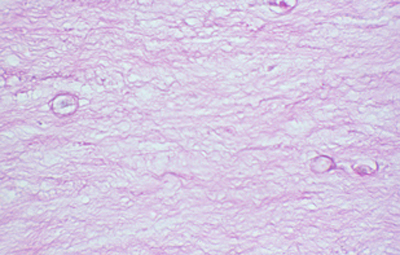
Fig. 52 PAS, Original x160
Bibliografía abreviada
- Rapid Diagnosis of Acanthamoeba Keratitis Using Calcofluor White, Wilhelmus KR, Osato MS, Font RL, Robinson NM, Jones DB, Arch Ophthalmol 1986; 104: 1309-1312.
- Evaluation of Hematoxylin and Eosin and Special Stains for the Detection of Acanthamoeba Keratitis in Penetrating Keratoplasties, Grossniklaus HE, Waring GO, Akor C, Castellano-Sanchez AA, Bennett K, Am J Ophthalmol 2003;136: 520-526
- Prognostic Factors Affecting Visual Outcome in Acanthamoeba Keratitis, Tu IH, Joslin CE, Sugar J, Shoff ME, Booton GC, Ophthalmology 2008; 115: 1998-2003.
